Journal of Controlled Release|汪世龙课题组构建的新型纳米核酸药物通过Sgk1/Foxo3a轴发挥抗炎/抗纤维化功能治疗炎性肠病
炎症性肠病(Inflammatory bowel disease,IBD)是一种以胃肠道炎症为特征的自身免疫性疾病,主要表现为黏膜和粘膜下层的持续炎症、上皮溃疡和肠壁纤维化。IBD的发病率在世界范围内继续增长,其病程长、并发症多、致残率高。
由于MicroRNAs(miRNAs)具有序列特异性靶向能力,已成为基因表达的关键调控因子。miR-29a具有调节免疫稳态和纤维化的能力,有望应用于IBD的治疗,但其调控靶点尚不清楚。基于miRNAs疗法的临床转化受到其易降解和难以跨越组织屏障的阻碍,而脂质纳米颗粒(LNP)强烈的炎症反应限制了其在抗炎药物中的应用,因此需要开发新型miRNAs递送系统以用于IBD等自身免疫疾病的治疗。
2025年8月28日,汪世龙课题组在Journal of Controlled Release杂志发表题为MiR-29a-loaded nanoparticles alleviate inflammatory bowel disease via Sgk1/Foxo3a axis的文章,首次揭示miR-29a能通过靶向降低Skg1的表达,增加Foxo3a的核定位来改善IBD炎症程度和纤维化进程,利用具有免疫应答抑制功能的层状双氢氧化物(LDH)纳米颗粒作为miR-29a的递送载体,构建了LDH@miR-29a纳米核酸药物,在IBD治疗中表现出优秀的治疗效果。该研究成果为同时改善IBD的持续炎症和肠壁纤维化提供了新的调控靶点,也为抗炎型核酸药物的递送提出了新的搭载策略。

研究者们首先利用离子交换及静电吸附的方法构建了LDH@miR-29a纳米药物,通过FBS共孵育、荧光标记和qPCR证实了LDH能很好的保护miR-29a不被核酸酶降解,并且能高效促进miR-29a向巨噬细胞的转染。利用LDH@miR-29a分别处理LPS诱导巨噬细胞构建的炎症细胞模型和TGF-β1诱导NIH3T3构建的纤维化细胞模型,发现LDH@miR-29a在体外能够显著抑制巨噬细胞中炎症因子的表达和ROS的产生,下调纤维化细胞模型中α-SMA、Collagen I、Collagen III等纤维化标志的表达并抑制细胞迁移。证实了LDH@miR-29a在体外具有抗炎和抗纤维化的双重作用。
为了探讨LDH@miR-29a抑制炎症和纤维化进程的作用机制,研究者们对治疗后的巨噬细胞炎症模型和NIH3T3纤维化模型进行了转录组测序,将测序结果与TargetScan数据库比对后筛选出了miR-29a的关键调控靶点Skg1,进一步通过DSS诱导的小鼠结肠炎和肠道纤维化模型,验证了LDH@miR-29a通过调节Sgk1/Foxo3a轴来抑制炎症和纤维化进展(图1)。
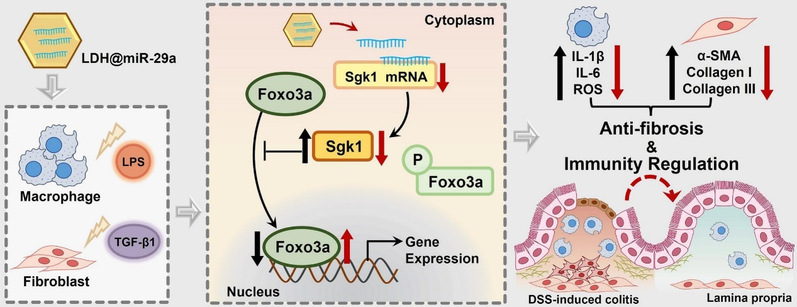
图1 LDH@miR-29a通过调节Sgk1/Foxo3a轴来抑制IBD中炎症和纤维化进展
综上,该研究发现了miR-29a抗炎和抗纤维化的关键机制,为IBD的治疗提供了新的靶点。构建了具有免疫稳态调节功能的新型核酸药物载体LDH,为抗炎型核酸药物的研制提供了新的递送平台,也为纳米材料在IBD治疗中的临床转化提出了新的策略。
天游线路检测中心和东方医院医学科学与技术创新中心汪世龙教授,上海宝山中西医结合医院李莉主任以及天游线路检测中心助理教授静国欣为本文的共同通讯作者。课题组牛金童博士为本文的第一作者。本课题得到了国家基金委和上海市科委等项目的资助。
Copyright© 2011-2015 天游线路检测中心 - 天游注册登录入口, All rights reserved
地址:上海市四平路1239号 电话:021-65981041 传真:65981041


